 При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Зависимость активности ферментов от температуры. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени.
При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Зависимость активности ферментов от температуры. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени.
Ферменты обладают всеми свойствами белков. Однако по сравнению с белками, выполняющими другие функции в клетке, ферменты имеют ряд специфических, присущих только им свойств. Температура может влиять по-разному на активность фермента. При высоких значениях температуры может происходить денатурация белковой части фермента, что негативно сказывается на его активности.
Различные клеточные ферменты имеют собственные температурные оптимумы, которые определяются экспериментально. Большинство ферментов проявляет максимальную активность при значениях рН, близких к нейтральным. Изменение оптимального для данного фермента значения рН-среды может привести к изменению третичной стурктуры фермента, что скажется на его активности.
Специфичность — это избирательность фермента по отношению к субстрату (или субстратам). Специфичность действия ферментов объясняется тем, что субстрат должен подходить к активному центру как «ключ к замку». Это образное сравнение сделано Э.Фишером в 1894 г. Он рассматривал фермент как жесткую структуру, активный центр которой представляет собой «слепок» субстрата.
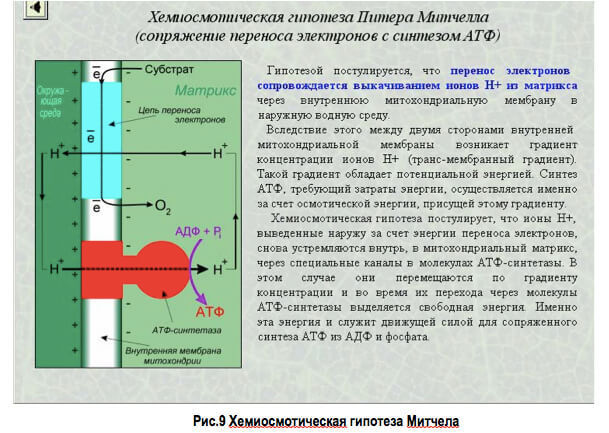
По гипотезе Д. Кошланда, молекула фермента не жесткая, а гибкая, эластичная, поэтому информация фермента и его активного центра может изменяться при присоединении субстрата или других лигандов. В момент присоединения (рис. 10) субстрат «вынуждает» активный центр фермента принять соответствующую форму. Это можно сравнить с «перчаткой» и «рукой».
Действие ферментов
Влияние на активность ферментов активаторов и ингибиторов. К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов — Сl-. Катионы действуют на ферменты по-разному.

Влияние концентрации фермента и субстрата.
Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Повышение скорости реакции по мере приближения к оптимальной температуре слева объясняется увеличением кинетической энергии реагирующих молекул. Вторичная и третичная структура фермента разрушается, что сопровождается потерей каталитической активности. Для большинства ферментов оптимальная температура равна или выше той температуры, при которой в норме находятся клетки.

2. Изменением величины заряда молекул субстрата или фермента. Активность фермента может изменяться в результате изменений либо его структуры, либо заряда функциональных остатков, участвующих в катализе или связывании субстрата. Рис. 8.13. Влияние pH на активность фермента. При изменении pH ферменты могут претерпевать конформационные изменения. При увеличении концентрации реактантов возрастают число молекул, обладающих достаточной для реакции энергией, и частота их столкновений.
Получение и применение ферментов
На начальном этапе скорость реакции прямо пропорциональна времени и имеет линейную зависимость. На этапе скорость реакции изменяется нелинейно в зависимости от времени. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов. Рис. 2-15. Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции.

По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция.
Активный центр фермента
Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента.

При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Таким образом, концентрация фермента — лимитирующий фактор в образовании продукта.
Vmах и Km — кинетические характеристики эффективности фермента. Из данных табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляют пепсин, рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен). Имеет значение, кроме того, состояние ионизации субстратов и кофакторов. Так, известны оксидазы L- и D-аминокислот, хотя в природных белках обнаружены только L-ами-нокислоты.
Химическая природа ферментов
КИНЕТИКА БИОХИМИЧЕСКИХ ПРОЦЕССОВ (дополнение к ст. , БМЭ, изд. II, т. 12) — учение о скоростях реакций, протекающих в живых организмах. При высоких , когда >> Кm, можно считать, что Кm + ≈ , и тогда уравнение (1) будет иметь вид v = к+2. Отсюда следует, что Кm численно равна той концентрации субстрата , при которой и будет составлять половину максимальной.
Он излагается в специальных руководствах по кинетике ферментативных реакций. С повышением температуры скорость биохимических процессов в определенном интервале температур возрастает. Температура оказывает влияние на отдельные стадии ферментативных процессов (скорость образования и распада ES, ЕР и т. д.) и, таким образом, меняет стационарную скорость реакции.
Влияние рН на ферментативную активность связано с амфотерными свойствами белков. Ka и Кb — соответственно константы диссоциации кислотных и основных групп фермента. Кинетическая характеристика ферментативных реакций, полученная в опытах in vitro, играет важную роль в оценке скоростей биохимических процессов в живой клетке и познании механизма действия ферментов. Однако огромное количество одновременно протекающих в клетке процессов нуждается в регуляции скоростей и направления отдельных реакций.
Температура, при которой каталитическая активность фермента максимальна, называется температурным оптимумом фермента. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.


