 Осмотические свойства белков. Белки являются амфотерными полиэлектролитами, т.е. сочетают в себе, подобно аминокислотам, кислотные и основные свойства. Осадок не образуется, поскольку в щелочной среде отрицательный заряд белка увеличивается.
Осмотические свойства белков. Белки являются амфотерными полиэлектролитами, т.е. сочетают в себе, подобно аминокислотам, кислотные и основные свойства. Осадок не образуется, поскольку в щелочной среде отрицательный заряд белка увеличивается.
Чтобы выделить белки из раствора или разделить белки по физико-химическим свойствам достаточно удалить один или оба фактора, обеспечивающих их растворимость — заряд и гидратную оболочку. Так как растворимость белков зависит только от них, то исчезновение одного или обоих этих факторов ведет к полному или частичному осаждению белка и, конечно, к потере его функций.
Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4).
Все это приводит к «слипанию» молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда.
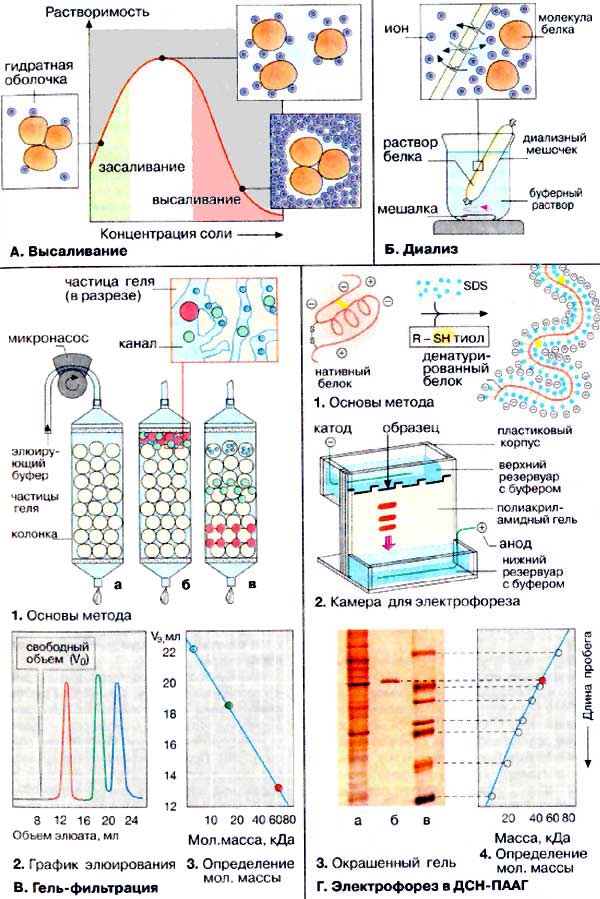
Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, одновременному уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы. В случае наступления какого-либо осложнения вопрос решается в зависимости от характера и течения осложнения. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции.

Одним из видов обратимого осаждения белков является высаливание. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония.

Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются.
Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами — в слабощелочной. Концентрированные кислоты (серная, хлористоводородная, азотная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки).
Осаждение водоотнимающими средствами
По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота. 45 градусов, осторожно по стенке наслаивают такой же объем яичного белка. На границе двух слоев появляется осадок белка в виде белого кольца.
Трихлоруксусная кислота осаждает только белки, а сульфосалициловая осаждает не только белки, но и высокомолекулярные пептиды. В две пробирки вносят по 5 капель раствора белка. В одну из них прибавляют 2 капли сульфосалициловой кислоты, а в другую — 5 капель трихлоруксусной кислоты. Осаждение белка солями тяжелых металлов.
Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле. В три пробирки вносят по 5 капель белка. В первую добавляют 1 каплю ацетата свинца, в третью — 1 каплю нитрата серебра. Аминокислотный состав и пространственная организация каждого белка определяют его физико-химические свойства.
Однако природа групп, придающих амфотерные свойства белкам, далеко не та же, что у аминокислот. У белка с четвертичной структурой число концевых групп —NН2 и —СООН равно числу субъединиц, или протомеров. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутаминовая и аминолимонная), а щелочные свойства — основные аминокислоты (лизин, аргинин, гистидин). Слабая диссоциация SН-группы цистеина и фенольной группы тирозина (их можно рассматривать как слабые кислоты) почти не влияет на амфотерность белков.

При набухании молекулы воды проникают в белок и связываются с его полярными группами
Белки хотя и обладают свойствами буфера, но емкость их при физиологических значениях рН ограничена. Исключение составляют белки, содержащие много гистидина, так как только боковая группа гистидина обладает буферными свойствами в интервале значений рН, близких к физиологическим.
Все, что способствует сохранению заряда и гидратной оболочки, облегчает растворимость белка и его устойчивость в растворе
Заряд белковой молекулы зависит от содержания в ней кислых и основных аминокислот, а точнее, от ионизации кислых и основных групп бокового радикала этих аминокислот. В нативной молекуле белка заряды распределяются асимметрично в зависимости от укладки полипептидной цепи в пространстве. Знание изоэлектрической точки очень важно для понимания стабильности белков в растворах, так как в изоэлектрическом состоянии белки наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.

Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка
Обычные коллоидные растворы устойчивы только в присутствии стабилизатора, который препятствует осаждению коллоидов, располагаясь на границе раздела «растворенное вещество — растворитель». Водные растворы белков являются устойчивыми и равновесными, они со временем не выпадают в осадок (не коагулируют) и не требуют присутствия стабилизаторов. Белковые растворы гомогенны и, в сущности, их можно отнести к истинным растворам.
При этом устойчивость вследствие нейтрализации зарядов теряется и белки выпадают в осадок. Поведение белков в растворах имеет некоторые особенности. Процесс осаждения белков нейтральными солевыми растворами называется высаливанием. Это свойство белков используют в практике для очистки их растворов от низкомолекулярных примесей. Осмотическое давление в очень разбавленных растворах белка пропорционально молярной концентрации белка и абсолютной температуре.


